Entstehung und Umwandlung von Salzen
Entstehung
Bei Salzen handelt es sich neben der in der Natur vorkommenden Metallbindung und Atombindung um die Ionenbindung.
- Salz = Metall-Ionen + Säurerest-Ion
- Kationen + Anionen
- positiv geladen + negativ geladen
Umwandlung
Aus Base und Säure entsteht Salz und Wasser:
- Ca(OH)2 + H2CO3 -> CaCO3 + 2 H2O
Das Salz (CaCO3) löst sich in Wasser und wird von diesem durch den Baustoff transportiert. Die Aufspaltung der Ionenbindung in wässriger Lösung wird als Dissoziation bezeichnet.
Schwindet das Wasser durch zum Beispiel Verdunstung, kristallisiert das Salz, wodurch es zu einer Volumenvergrößerung und somit zur Zerstörung des Gefüges der Baustoffe kommt.
Legende
- Ca(OH)2 -> Calciumhydroxid
- H2CO3 -> Kohlensäure (schwache Säure aus Luft)
- CaCO3 -> Calciumcarbonat
- H2O -> Wasser
- H2SO4 -> Schwefelsäure (starke Säure)
- CaSO4 -> Calciumsulfat
- CaSO4 * 2 H2O -> Gips
Bauschädliche Salze
Bei den bauschädlichen Salzen handelt es sich um Sulfate, Chloride und Nitrate. Jedes Salz hat besondere Eigenschaften, weshalb es für eine gezielte und erfolgreiche Sanierung unerlässlich ist zu wissen, welche Salze vorhanden sind. Die Salze lassen sich wie folgt aufgliedern:
|
Kationen/Anionen
|
Sulfat [sehr kristallisierend]
|
Chlorid [sehr hygroskopisch]
|
Nitrat [sehr kristallisierend und hygroskopisch]
|
|---|---|---|---|
|
Magnesium
|
Magnesiumsulfat (Bittersalz) [häufige Wechsel der Hydratstufen]
|
Magnesiumchlorid [stark hygroskopisch]
|
Magnesiumnitrat [hygroskopisch, kristallisationsaktiv]
|
|
Calcium
|
Calciumsulfat (Gips) [einmalige Volumenzunahme, hygrische Dehnung]
|
Calciumchlorid [stark hygroskopisch]
|
Calciumnitrat (Mauersalpeter) [hygroskopisch, kristallisationsaktiv]
|
|
Natrium
|
Natriumsulfat (Glaubersalz) [häufige Wechsel der Hydratstufen]
|
Natriumchlorid (Speisesalz) [hygroskopisch]
|
Natriumnitrat (Natronsalpeter) [hygroskopisch, kristallisationsaktiv]
|
|
Kalium
|
Kaliumsulfat [häufige Wechsel der Hydratstufen]
|
Kaliumchlorid (Kalisalz) [wenig hygroskopisch]
|
Kaliumnitrat (Kalisalpeter) [wenig hygroskopisch]
|
|
Ammonium
|
Ammoniumsulfat [stark Beton schädigend]
|
Ammoniumchlorid (Salmiak) [stark Beton schädigend]
|
Ammoniumnitrat (Ammonsalpeter) [hygroskopisch]
|
Anionen
- SO42- -> Sulfat
- Cl– -> Chlorid
- NO3– -> Nitrat
Kationen
- Mg2+ -> Magnesium
- Ca2+ -> Calcium
- Na+ -> Natrium
- K+ -> Kalium
- NH4+ -> Ammonium
Quellen von Salzen
Kationen-Quellen
-> Calcium
- Baustoffe wie Kalkmörtel, Beton und kalkhaltige Natursteine
- trockene Ablagerungen (Deposition) wie Industriestaub oder Baustofflager
- Grundwasser mit hoher Härte/Spritzwasser
-> Magnesium
- Baustoffe wie dolomithaltige Mörtel und Natursteine, Ziegel. Dolomit ist chemisch gesehen ein Calcium-Magnesium-Carbonat
- trockene Ablagerungen (Deposition) wie Industriestaub oder Baustofflager
- Grundwasser mit hoher Härte/Spritzwasser
- Düngemittel
- Winterdienst mit Magnesialauge (wässriges Magnesiumhydroxid) auf nahe gelegenen Straßen
-> Natrium und Kalium
- zementhaltige und trasshaltige Baustoffe
- Tausalze auf Wegen, in Grundwasser und Spritzwasser sowie im Mörtel
- frühere Behandlung mit Natrium- bzw. Kaliumwasserglas oder alkalischen Materialien (heutzutage unüblich)
-> Ammonium
- Harnstoffe von zum Beispiel Tierhaltung oder Toiletten
- Düngemittel
Anionen-Quellen
-> Sulfat (Schwefel)
- Luftverunreinigung durch Verbrennung von schwefelhaltiger Kohle und Erdöl (Industrie, Hausbrand)
- Baustoffe (gipshaltige Baustoffe, gebrannte Ziegel
- Grundwasser und Spritzwasser
-> Nitrat
- Düngemittel, Tierhaltung und Verwesungsprodukte (Friedhof)
- Fäkalien (Toiletten)
- Ablagerungen (Deposition) aus Luft und Regenwasser (insbesondere Tierhaltung in der Umgebung)
- Grundwasser
- Autoabgase und andere Hochtemperaturverbrennungen
-> Chlorid
- Tausalze auf Wegen und im Mörtel
- Verwendung von Chlorwasserstoff als Reinigungsmittel beim Reinigen
- Luftverschmutzung (Verbrennung von Polyvinylchlorid)
- Grundwasser und Spritzwasser
Wie Salze Schaden anrichten
Kristallisationsdruck
Kristallisationsdruck entsteht, wenn gelöste Salze in Porenlösungen kristallisieren und dabei mechanischen Druck auf die Porenwände des Materials ausüben. Dies geschieht häufig, wenn wasserlösliche Salze in ein poröses Material eindringen und das Wasser durch Verdunstung entfernt wird.
Hydratationsdruck
Hydratationsdruck entsteht, wenn bestimmte Stoffe in Kontakt mit Wasser hydratisieren, d. h., sie binden Wasser in ihre Kristallstruktur. Dieser Prozess führt zu einer Volumenzunahme und kann ebenfalls mechanischen Druck erzeugen. Ein Beispiel wäre Gips, welches durch Wasserzugabe zu Calciumsulfat-Dihydrat reagiert.
Hygroskopie
Zusätzlich zum Baustoff nimmt auch das Salz weiter Feuchtigkeit auf, wodurch der Baustoff durchfeuchtet wird und das Salz in gelöster Form weiter transportiert wird. Salz in Kristallstrukturen bilden Kapillarröhren, wodurch Flüssigkeiten weiter nach oben steigen können.
Wasser in Baustoffen
Chemisch gebundenes Wasser
Hierbei handelt es sich um Bestandteile von chemischen Verbindungen. Dieses Wasser entbindet sich erst unter hohen Temperaturen, wobei es dabei den Baustoff schädigt.
Hydratwasser
In Salz eingelagertes Wasser, welches bereits bei Temperaturen ab 45 °C entbunden wird.
Wasser in Gelporen
Wasserstoffbrückenbindung, welche sehr klein sind (nm-Bereich). Dieses Wasser entbindet sich erst unter hohen Temperaturen, wobei es dabei den Baustoff schädigt.
Kritisch: Wasser in Kapillar- und Luftporen
- Kapillarkondensation in größeren Poren
- Kapillarsog, Adsorptionswasser
- mobiles Wasser
Deliqueszenzfeuchte
Bei der Deliqueszenzfeuchte handelt es sich um eine Art Gleichgewichtsfeuchte. Diese bezieht sich jedoch speziell auf Salze und gibt an, bei welcher relativen Raumluftfeuchte ein Salz in Dissoziation, also in wässriger Lösung, oder in kristalliner Struktur vorhanden ist.
Beispiel: ein Raum hat eine relative Luftfeuchtigkeit von 50 %. Die Materialien in dem Raum nehmen die Feuchtigkeit bis zur Gleichgewichtsfeuchtigkeit auf – also in dem Falle 50 %. Das Salz Kalksalpeter (Calciumnitrat-Tetrahydrat) hat eine Deliqueszenzfeuchte von 54 %. Bei Calciumchlorid (Calciumchlorid-Hexahydrat) liegt diese bei 33,7 %. Dies bedeutet nun, dass bei der relativen Luftfeuchte von 50 % das Kalksalpeter in kristalliner Form und das Calciumchlorid in wässriger Lösung vorhanden ist.
Porenarten
- geschlossene Poren; Gelporen und chemisch gebundenes Wasser
- Kapillarporen; müssen 0,1 – 100 µm groß sein, damit diese Feuchtigkeit kapillaraktiv (entgegen Erdanziehungskraft) transportieren. Je schmaler, desto höher wird die Feuchtigkeit transportiert
- Sackporen; münden in einer Sackgasse
- Kugelporen/Luftporen; sind großvolumige Poren, welche den Kapillartransport unterbrechen
Brownsche Molekularbewegung
Die Wasserdampfdiffusion in einem Baustoff finden im wesentlichen durch die sogenannte „Brownsche Molekularbewegung“ statt. Dies bedeutet, dass die Molekluarbewegung zufällig, ungerichtet und spontan von kleinsten Teilchen in einem flüssigen oder gasförmigen Zustand stattfinden.
Dabei versuchen sich die Teilchen stehts auszugleichen – von hoher Konzentration zu niedriger Konzentration. Die Teilchen streben einen Gleichgewichtszustand an. Somit hängt die Wasserdampfdiffusion, also der Teilchenausgleich zwischen der Außenluft und der Innenluft von folgenden Faktoren ab:
- Konzentration
- Luftdruck
- Temperatur
- Porösität des Baustoffes
Kapillartransport
Der Kapillartransport von Feuchtigkeiten innerhalb Baustoffen, also die Durchwanderung der Baustoffe mit Feuchtigkeit – auch entgegen der Schwerkraft, ist neben der Größe der Kapillarporen auch vom Benetzungswinkel der Flüssigkeit abhängig.
Je flacher der Benetzungswinkel, desto höher die Kapillarität. Wird ein Baustoff oder generell ein Stoff hydrophobiert bzw. imprägniert, erhöht sich signifikant der Benetzungswinkel. Perlen die Flüssigkeiten augenscheinlich ab, beträgt der Benetzungswinkel bis zu 180°.
Salzuntersuchungen
Warum müssen wir Schäden vor der Instandsetzung hinsichtlich:
- Salzart
- Konzentration
überprüfen?
Wir hatten bereits aufgezeigt, dass jedes Salz verschiedene Eigenschaften hat. Sulfate sind sehr kristallin und zerstören dadurch den Baustoff. Diese sind wiederum nur in oberflächennähe in bedenklicher Konzentration vorhanden, also unproblematisch im Bautielquerschnitt bzw. in der Bauteiltiefe. Chloride sinde sehr hygroskopisch und leiten gut Wasser. Nitrate wiederum können beides sehr gut, also Feuchtigkeit leiten und zu schäden führen – über den gesamten Querschnitt des Bauteils.
Damit eine Sanierung langfristig effektiv ist, muss für das jeweilige Salz und die daraus resultierenden Schäden inkl. der sich ergebenden Salzquellen analysiert werden.S anierungsmaßnahmen können sein:
- Bauwerksabdichtung
- Sanierputz
- Salzreduzieren
- weitere …
Einfache Verfahren
-> Quantitativer Ionennachweis
Ein einfaches jedoch auch zerstörendes Analyseverfahren ist die Entnahme einer Baustoffprobe. Der Vorteil ist, dass Salzgehalt und Feuchtigkeit ermittelt werden können.
Die Probe muss jedoch entsprechend behandelt sein, also getrockent und zerkleinert.
- Bestimmung der elektrischen Leitfähigkeit des Eluates; keine Bestimmung welche Salze vorhanden sind
- Gravimetrische Bestimmung des Eindampfrückstandes; empfohlenes Analyseverfahren
-> Qualitativer Ionennachweis mit Merck-Teststäbchen
Teststäbchen wird auf Oberfläche gedrückt. Farbindikator verfärbt sich und zeigt auf, welches Salz vorhanden ist. Ist das Salz in kristalliner Form vorliegend, muss das Salz mit destilliertem Wasser verflüssigt werden. Dieses Analyseverfahren kann nicht den Salzgehalt feststellen.
- Einfach, kostengünstig
- keine Angabe von Kation-Anion-Bindungen (je Ionenbindung ein gesondertes Teststäbchen erforderlich)
- keine Angabe von Salzgehalten
Quantitative Verfahren (Menge)
-> Photometrie
Das photometrische Verfahren basiert auf der Messung der Lichtabsorption einer Lösung. Es wird verwendet, um die Konzentration bestimmter Stoffe in einer Probe zu bestimmen.
Wie funktioniert es?
- Farbgebung durch Reagenzien:
Ein chemisches Reagenz wird zur Probe hinzugegeben. Dieses reagiert spezifisch mit dem gesuchten Stoff (z. B. einem Ion) und bildet dabei einen farbigen Komplex.
Die Intensität der Farbe hängt direkt von der Konzentration des Stoffes ab. - Lichtabsorption:
Die Lösung wird in ein Photometer gestellt, das Licht einer bestimmten Wellenlänge (passend zur Farbe der Lösung) durch die Probe schickt.
Die Menge des absorbierten Lichts (Absorption) wird gemessen. - Konzentrationsbestimmung:
Anhand der gemessenen Absorption und einer Vergleichskurve (Kalibrierung mit Proben bekannter Konzentration) kann die Konzentration des gesuchten Stoffes in der Probe bestimmt werden.
Beispiel: Nitratbestimmung: Nitrat-Ionen reagieren mit einem Reagenz und bilden eine gelbe bis orangefarbene Lösung. Die Absorption dieser Farbe wird gemessen, um die Nitratkonzentration zu berechnen.
- Einfach durchführbar.
- Günstig und schnell.
- Hohe Empfindlichkeit bei klaren Lösungen.
- Störungen durch Verunreinigungen oder andere farbige Stoffe in der Probe.
- Eignet sich meist nur für eine Ionenart gleichzeitig.
-> Ionenchromatographie
Die Ionenchromatografie (IC) ist ein hochpräzises Verfahren zur Trennung und Analyse von Ionen in wässrigen Proben. Sie wird häufig zur gleichzeitigen Bestimmung mehrerer Kationen und Anionen eingesetzt.
- Sehr präzise und empfindlich.
- Kann viele Ionen in einer einzigen Analyse identifizieren und quantifizieren.
- Breites Anwendungsspektrum, auch für komplexe Proben (z. B. Abwässer, Lebensmittel, Trinkwasser).
- Teure Geräte und Wartung.
- Benötigt gut ausgebildetes Personal.
- Zeitaufwendiger als photometrische Verfahren.
Nasschemische Verfahren (quantitativ, Auszug)
-> Titration
Auch bei diesem Verfahren wird eine Bustoffprobe entnommen, zerkleinert und gewogen. Für die weitere Analyse ist muss die Probe zusätzlich fein zerkleinert werden. Dabei wird die Konzentration des Salzes mit Hilfe einer „Maßlösung“ (Base mit bekannter Konzentration) und einem Indikator geprüft. Der Indikator ist ein Färbemittel, welches seine Farbe ändert, sobald ein bestimmter pH-Wert in der Lösung vorhanden ist. Es wird solange die Maßlösung hinzugegeben, bis der Indikator anschlägt, wodurch die Konzentration mit Hinzuziehung des Volumens bestimmt werden kann.
- Wird bevorzugt für schnelle und routinemäßige Analysen (z. B. Wasserhärte, Säure-Basen-Bestimmungen).
- Gut geeignet für Proben mit moderatem Präzisionsanspruch.
-> Gravimetrie
Die Gravimetrie ist eine quantitative Analysemethode, bei der ein bestimmter Stoff in einer Probe durch chemische Reaktionen in eine schwer lösliche Verbindung (Niederschlag) überführt wird. Dieser Niederschlag wird abfiltriert, getrocknet oder geglüht und anschließend gewogen. Aus der Masse des Niederschlags kann die Menge des gesuchten Stoffes in der Probe berechnet werden.
- Wird eingesetzt, wenn höchste Genauigkeit erforderlich ist, z. B. bei der Herstellung von Referenzmaterialien oder der Validierung anderer Methoden.
- Besonders nützlich, wenn keine präzise Reagenzlösung für eine Titration verfügbar ist.
Messung Mauerwerksfeuchte (zerstörend)
-> Darr-Methode
Bei der Darr-Methode handelt es sich um ein quantitatives Feuchtemessverfahren, bei der eine Probe durch physische Einwirkung aus einem Baumaterial entnommen wird. Die Probe muss unmittelbar nach der Entnahme gewogen werden. Nachfolgend wird diese in einem Trockenschrank bis auf 0 % Restfeuchte getrocknet und erneut gewogen. Die Gewichtsdifferenz zwischen getrocknetem und feuchtem Material gibt die Menge an Wasser an.
Vorteile:
- direkte Messung des Feuchtegehaltes, dadurch kann mit diesem Verfahren ein sogenannter „Referenzwert“ ermittelt werden und andere Verfahren an diesem abgeglichen werden.
- international standardisierte Feuchtemessmethode
- Bezugswert zu allen anderen Feuchtemessverfahren
Fehlerquellen:
- Wägeungenauigkeit
- zu lange Lagerungszeit zwischen Probenahme und erster Wägung
- eventuell starke Wärmeentwicklung beim Bohren und damit Verdunstung von Feuchtigkeit vor erster Wägung
- eventuell Herauslösen des Hydratwasser von Salzen
-> Calciumcarbid-Methode
Die Methode basiert auf einer chemischen Reaktion zwischen Wasser und Calciumcarbid (CaC₂). Dabei entsteht Acetylengas (C₂H₂), dessen Druck in einem geschlossenen System gemessen wird.
Probenentnahme:
- Eine Probe des Materials (z. B. Estrich) wird entnommen und in einer definierten Menge zerkleinert.
Reaktion mit Calciumcarbid:
- Die zerkleinerte Probe wird zusammen mit Calciumcarbid in eine druckdichte Stahlkugel gegeben.
- Die Kugel wird verschlossen und geschüttelt. Dabei reagiert das Wasser in der Probe mit dem Calciumcarbid zu Acetylengas
Druckmessung:
- Der entstehende Gasdruck (Acetylen) wird mit einem Manometer gemessen.
- Der Druck ist proportional zum Wassergehalt der Probe.
Feuchtebestimmung:
- Aus dem gemessenen Druck wird mithilfe einer Kalibrierskala der Feuchtegehalt der Probe in Prozent berechnet.
Messung Mauerwerksfeuchte (elektrisch)
-> Widerstandsverfahren
Hier wird zwischen zwei Elektroden ein geringer Strom durch das feuchte Material geleitet, um dessen elektrischen Widerstand zu bestimmen. Je höher der Wassergehalt, desto besser leitet das Material und desto geringer ist der gemessene Widerstand. Dieses einfache, kostengünstige Verfahren ist stark von Materialeigenschaften abhängig und oft invasiv, weil Elektroden in das Material eingeschlagen werden müssen.
Folgende Faktoren beeinflussen den Messwert:
- Widerstandsverfahren reagieren stark auf salz- und ionenhaltige Feuchten, d. h. Feuchtigkeit mit höheren Ionenanteilen (z. B. bei Mauerwerksdurchfeuchtungen mit Salzen) kann den Widerstand stark senken und Messungen verfälschen.
- Widerstandsverfahren sind temperaturabhängig, da elektrische Leitfähigkeit mit steigender Temperatur zunimmt.
-> Dielektrizitätskonstante
Die Dielektrizitätskonstante eines Baustoffs ändert sich mit dem Feuchtegehalt, da Wasser eine hohe Permittivität besitzt. Ein Messgerät erzeugt ein hochfrequentes elektrisches Feld und misst die Veränderung der Kapazität am Messpunkt. Diese Methode ist in der Regel zerstörungsfrei, schnell und eignet sich gut für Vergleichs- oder Orientierungsmessungen, erfordert jedoch oft eine Kalibrierung für das jeweilige Material.
Es gilt zu beachten:
- Kapazitive Verfahren sind von der individuellen Dielektrizitätskonstante des Materials abhängig und müssen entsprechend kalibriert werden.
- Beeinflussung von Salzen geringer als beim Widerstandsmessverfahren.
-> Mikrowellenverfahren
Mikrowellen werden in das Material eingestrahlt und deren Reflexion oder Transmission gemessen. Da Wasser stark auf Mikrowellen reagiert, lassen sich aus den gemessenen Veränderungen Rückschlüsse auf den Feuchtegehalt ziehen. Dieses Verfahren ermöglicht tiefergehende Messungen, ist berührungslos und nicht-destruktiv, erfordert aber in der Regel komplexere Auswertungen und Kalibrierungen.
Es gilt zu beachten:
- Mikrowellenverfahren reagieren auf die materialtypischen Dämpfungs- und Reflexionseigenschaften. Unterschiedliche Baustoffe (z. B. Beton vs. Holz) erfordern eine angepasste Interpretation.
- Salze beeinflussen indirekt die dielektrischen Eigenschaften. Die Auswirkung auf den Messwert ist gering.
- Es ist eine Kalibrierung für jedes Material notwendig, daher ist das Mikrowellenverfahren als alleiniges Messverfahren eher ungeeignet.
Planung von Untersuchungen
Allgemeine Struktur
- Orientierende Vor-Ort-Begehung
- Schadensaufnahme mit:
- Fotografien
- Kartierung
- Visueller Beobachtung
- Prüfen und Studieren archivierter Unterlagen
- Befragung von Personen wie Nutzer, Eigentümer, Hausmeister, Nachbar, usw.
- Festlegung der Untersuchungsziele
- Festlegung der Untersuchungsverfahren
- Planung der Probenahmen (Art, Zeitpunkt, Probenahmestellen)
- Planung der Analysen (welche Analysen an welchen Proben)
- Durchführung der Untersuchungen am Objekt und im Labor
- Ergebnisauswertung und Diagnose
- Maßnahmenplanung zur Instandsetzung
Arten von Probeentnahmen
-> Bohrkernentnahme (Diamantkrone)
- ungestörter Bohrkern
- Zerstörung je nach Durchmesser des Bohrkerns gering bis stark
-> Bohrkernentnahme (Hammerkrone)
- gestörter Bohrkern
- Zerstörung je nach Durchmesser des Bohrkerns gering bis stark
-> Normaler Spiralbohrer
- Bohrmehl
- gestörte Probe
- Zerstörung gering
-> Hammer und Meißel
- gestörte Probe
- Zerstörung je nach Vorgehen gering bis stark
-> Herausschneiden (Trennschleifer)
- ungestörte Probe
- Zerstörung stark
-> Ausbau
- ungestörte Probe
- sehr starke Zerstörung
Planung der Probenahme
Probenahmen sind zu planen und vorzubereiten. Hierbei spielt vor allem die Zielstellung eine zentrale Rolle. Es sollten dabei folgende Aspekte beachtet werden:
- Soll ein Feuchteprofil mittels Rastermessung erstellt werden?
- Soll ein Feuchteprofil hinsichtlich der Tiefe der Bohrungen erstellt werden?
- Wie viele Bohrungen sollen erstellt werden?
- Wird eine ungestörte Probe benötigt?
Ursachenableitung aus Feuchteprofil
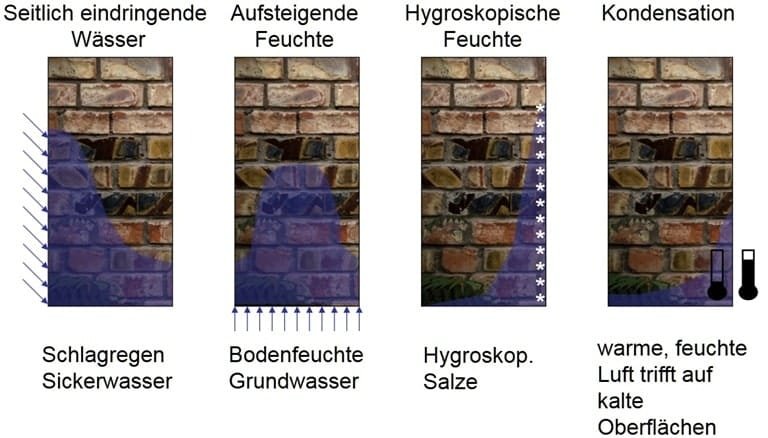
Auswertung der Feuchtemessung
Um die Durchfeuchtung eines Materials zu Bewertung, ist es sinnvoll, den Durchfeuchtungsgrad zu ermitteln.
1. Feuchtegehalt
FG = (mf – mtr)/mtr*100 %
Legende
- mf =
- mtr =








